Los gobiernos nacionales tienen las competencias de organización de la asistencia sanitaria y pueden decidir cuáles son las partidas nacionales que se destinan a la investigación médica. Sin embargo, la UE también asigna recursos públicos a la I+D en salud: en el periodo 2014-2020, habrá invertido 7.500 millones de euros para mejorar la asistencia y la investigación sanitaria europea a través del programa de investigación Horizonte 2020.
Texto: Esther Herrera
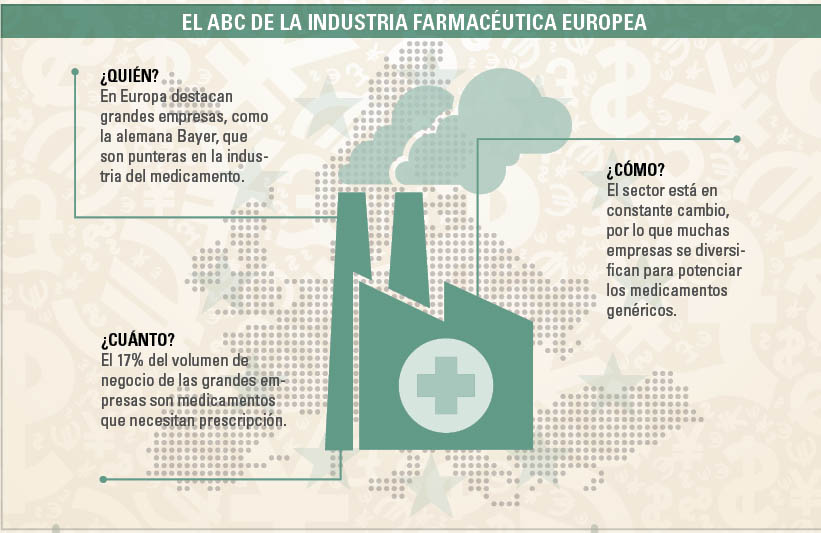
En el ámbito de la investigación médica en la UE, la industria farmacéutica es la potencia más destacada. Desde el Ejecutivo comunitario admiten los cambios que se están produciendo en el sector, especialmente porque medicamentos considerados ‘superventas’ (con más de 1.000 millones de euros anuales en comercializaciones) han dejado de estar protegidos por las patentes, y otros pronto se encontrarán en la misma situación. Por eso, según un informe publicado por la Comisión Europea, cada vez más empresas grandes empiezan a adquirir compañías más pequeñas, que basan su negocio en la producción de medicamentos genéricos para diversificarse; otras también han encontrado un hueco en la biotecnología.
El sector se basa en la I+D y hay dos tipos de empresas: por un lado, las conocidas como originarias (que se dedican a la investigación, el desarrollo y la gestión del proceso regulador de nuevos productos), y que reciben parte de sus beneficios de las patentes que, en parte, cubren los costes de la inversión en innovación; y, por el otro, las empresas de genéricos. Durante el último periodo de 2007 a 2014, el 17% del volumen de negocio de las empresas originarias correspondió a medicamentos que necesitan prescripción. La Comisión Europea explica que el sector farmacéutico es atípico, porque no se regula sólo por la oferta y la demanda, en tanto que muchos medicamentos necesitan prescripción para poder ser comprados.
Después de tres años de negociaciones, la UE ha puesto en marcha una mejora de la legislación para reforzar la seguridad de los dispositivos médicos
La industria farmacéutica no ha parado de crecer en la UE. En España, su aumento es sostenido, y según datos del Instituto Nacional de Estadística, este último año ha superado el 2%. Por esta razón, Barcelona ha sido una de las candidatas a acoger la Agencia Europea del Medicamento (EMA), que antes de marzo del 2019 abandonará Londres, justo cuando se produzca la salida del Reino Unido de la UE (la EMA se encarga de autorizar la entrada de nuevos medicamentos en el mercado y ayuda a los reguladores nacionales a coordinarse con respecto a la eficacia y seguridad de los medicamentos). En los últimos meses, el Gobierno español ha defendido reiteradamente las múltiples oportunidades que podía ofrecer la Ciudad Condal como nueva sede de la Agencia, no solo por su buena situación geográfica, sino también por el hecho de concentrar un hub tecnológico e innovador. Finalmente, sin embargo, la EMA se trasladará a Ámsterdam.
El papel de Bruselas
En cuestiones de salud, Bruselas defiende que son los estados los que tienen las competencias. Pero el comisario de Salud y Seguridad Alimentaria, Vytenis Andriukaitis, subraya «el papel» de la institución para ayudar a los países en la prevención de enfermedades. La actuación contra cánceres tan comunes en la población europea como el de mama, el de cuello de útero y el colorrectal es un ejemplo: así, se han llevado a cabo programas europeos para hacer prevención (se han facilitado directrices sobre la garantía de los tratamientos, al mismo tiempo que se aseguraba la puesta en común de los conocimientos y recursos disponibles en este sentido entre todos los estados miembros). Además, la UE también participa en la lucha contra el tabaquismo a través de la legislación y mediante acciones para impactar en la sensibilidad de la población, tales como campañas para advertir sobre sus efectos en la salud.
Por otro lado, la regulación también es básica. Así, después de tres años de negociaciones, la UE ha puesto en marcha una mejora de la legislación para reforzar la seguridad de los dispositivos médicos: desde las simples lentes de contacto hasta los adhesivos o los marcapasos más modernos, todos estos instrumentos necesitan actualizarse gracias a un nuevo marco jurídico. El pasado mes de abril, la normativa, que databa de los años 90, se modificó teniendo en cuenta los últimos avances médicos. Este cambio también tiene el objetivo de proteger mejor a los consumidores, especialmente en cuanto a los productos que conllevan más riesgos (como las lentes de contacto de colores o los procedimientos para la inseminación in vitro) se refiere. Asimismo, Bruselas ha puesto en marcha una nueva base de datos, conocida como EUDAMED, para que todos los países puedan saber de primera mano cuáles son los instrumentos médicos y cuál es su vida útil.
Lee también: Entrevista a Vytenis Andriukaitis, comisario europeo de Salud y Seguridad Alimentaria