Els governs nacionals tenen les competències d’organització de l’assistència sanitària i poden decidir quines són les partides nacionals que es destinen a la investigació mèdica. Tot i així, la UE també assigna recursos públics a l’R+D en salut: en el període 2014-2020, haurà invertit 7.500 milions d’euros per millorar l’assistència i la investigació sanitària europea a través del programa d’investigació Horitzó 2020.
Text: Esther Herrera
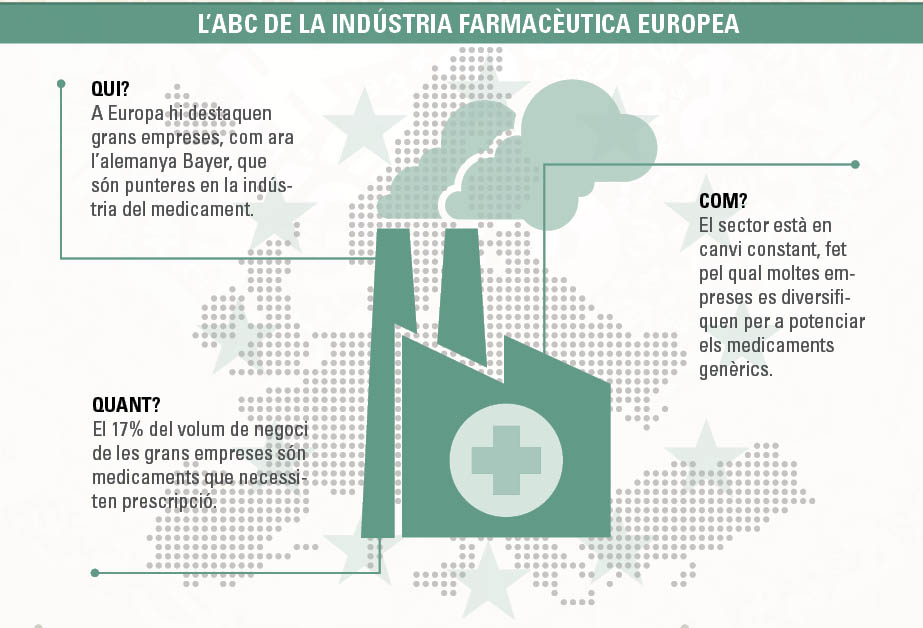
En l’àmbit de la investigació mèdica a la UE, la indústria farmacèutica n’és la potència més destacada. Des de l’Executiu comunitari admeten els canvis que s’estan produint en el sector, especialment perquè medicaments considerats ‘supervendes’ (amb més de 1.000 milions d’euros anuals en comercialitzacions) han deixat d’estar protegits per patents i d’altres aviat es trobaran en la mateixa situació. Per aquesta raó, segons un informe publicat per la Comissió Europea, cada cop més empreses grans han començat a adquirir companyies més petites, que basen el seu negoci en la producció de medicaments genèrics per diversificar-se; d’altres també han trobat un forat en la biotecnologia.
El sector es basa en l’R+D i hi ha dos tipus d’empreses: d’una banda, les conegudes com a originàries (que es dediquen a la investigació, el desenvolupament i la gestió del procés regulador de nous productes), i que reben part dels seus beneficis de les patents que, en part, cobreixen els costos de la inversió en innovació; i, de l’altra, les empreses de genèrics. Durant l’últim període del 2007 al 2014, el 17% del volum de negoci de les empreses originàries va correspondre a medicaments que necessiten prescripció. La Comissió Europea explica que el sector farmacèutic és atípic, perquè no es regula només per l’oferta i la demanda, en tant que molts medicaments necessiten prescripció per poder ésser comprats.
Després de tres anys de negociacions, la UE ha posat en marxa una millora de la legislació per reforçar la seguretat dels dispositius mèdics
La indústria farmacèutica no ha parat de créixer a la UE. A Espanya, el seu augment és sostingut, i segons dades de l’Institut Nacional d’Estadística, aquest últim any ha superat el 2%. Per aquesta raó, la ciutat de Barcelona ha estat una de les candidates a acollir l’Agència Europea del Medicament (EMA), que abans del març del 2019 ha d’abandonar Londres, tot just quan es produeixi la sortida del Regne Unit de la UE. En els darrers mesos, el Govern espanyol ha defensat reiteradament les múltiples oportunitats que la Ciutat Comtal podia oferir com a nova seu de l’Agència, no només per la seva bona situació geogràfica, sinó també pel fet que hi concentra un hub tecnològic i innovador. Malgrat això, finalment, l’EMA es traslladarà a Amsterdam.
El paper de Brussel·les
En qüestions de salut, Brussel·les defensa que són els estats els qui en tenen les competències. Però el comissari de Salut i Seguretat Alimentaria, Vytenis Andriukaitis, subratlla “el paper” de la institució per ajudar els països en la prevenció de malalties. L’actuació contra càncers tan comuns en la població europea com ara el de mama, el de coll d’úter i el colorectal n’és un exemple: així, s’han dut a terme programes europeus per fer-ne prevenció (s’han facilitat directrius sobre la garantia dels tractaments, alhora que s’assegurava la posada en comú dels coneixements i recursos disponibles en aquest sentit entre tots els estats membres). A més, la UE també participa en la lluita contra el tabaquisme a través de la legislació i mitjançant accions per impactar en la sensibilitat de la població, com ara campanyes per advertir sobre els seus efectes en la salut.
D’altra banda, la regulació també és bàsica. Així, després de tres anys de negociacions, la UE ha posat en marxa una millora de la legislació per reforçar la seguretat dels dispositius mèdics: des de les simples lents de contacte fins als adhesius o els marcapassos més moderns, tots aquests instruments necessiten actualitzar-se gràcies a un nou marc jurídic. El passat mes d’abril, la normativa, que datava dels anys 90, es va modificar tenint en compte els darrers avenços mèdics. Aquest canvi també té l’objectiu de protegir millor els consumidors, especialment quant als productes que comporten més riscos (com ara les lents de contacte de colors o els procediments per a la inseminació in vitro). Així mateix, Brussel·les ha posat en marxa una nova base de dades, coneguda com a EUDAMED, perquè tots els països puguin saber de primera mà quins són els instruments mèdics i quina és la seva vida útil.
Llegeix també: Entrevista a Vytenis Andriukaitis, comissari europeu de Salut i Seguretat Alimentària